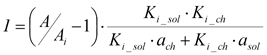Институт молекулярной биологии и генетики, НАН Украины, Киев
Институт экогигиены и токсикологии им. Л.И. Медведя МЗ Украины, Киев
Картофель является одной из главных сельскохозяйственных культур, которую выращивают около 80% стран мира и потребляют все слои населения. В составе картофеля помимо веществ, представляющих питательную ценность и обеспечивающих его вкусовые качества, обнаружены соединения, обладающие биологической активностью и токсическими свойствами [1, 2].
К природным токсинам картофеля прежде всего следует отнести гликоалкалоиды (ГА), преимущественно a-соланин (b-chaconine-D-galactopyranoside) и a-чаконин (b-chaconine-D-glucopyranoside). Они обеспечивают природную защиту картофеля от фунгицидов и инсектицидов, обладают антихолинэстеразным и мембраннотропным действием, а также жгуче-горьким отпугивающим насекомых вкусом. Суммарное содержание a-соланина и a-чаконина в кожуре и прилегающем к ней мякоти картофеля значительно выше, чем в сердцевине — соответственно 12—100 мг и 300—600 мг на 1 кг сырого веса клубней, а их соотношение обычно составляет 40/60. Содержание и соотношение этих ГА сильно варьирует в зависимости от сорта картофеля, условий его хранения и степени повреждения. Процессы приготовления картофеля существенно не разрушают ГА. При хранении на свету концентрация ГА может увеличиваться в 5—7 раз. Особенно высокие концентрации ГА (2000—5000 мг/кг) имеются в проростках картофеля. Именно с потреблением позеленевшего на свету, горького картофеля и его проростков связывают случаи отравления среди людей и животных. Анализ этих случаев позволил установить, что у людей, которые потребляли с картофелем ГА в дозах 2—5 мг/кг массы тела, отмечались симптомы отравления, а при дозах 3—6 мг/кг — смертельные исходы [1—5].
Молекулы a-соланина и a-чаконина состоят из одинакового неполярного стероидного ядра (соланидина) и полярного трисахаридного звена, что во многом определяет антихолинэстеразный и пермеабилизирующий (повреждающий мембраны) характер их токсического действия [6—9]. Симптомы отравления наступают через 8—12 ч после потребления картофеля и проявляются желудочно-кишечными (тошнота, рвота, понос) и неврологическими (учащенное дыхание и сердцебиение, спазмы желудка, головная боль, головокружение, сонливость, коматозное состояние) расстройствами [2—5]. a-Соланин и a-чаконин обратимо ингибируют ключевой фермент нервно-мышечной передачи — ацетилхолинэстеразу (АХЭ), а также бутирилхолинэстеразу (БХЭ) крови, имеющую, вероятно, детоксицирующую функцию [9]. В эксперименте на животных показано эмбриотоксическое и тератогенное действие этих соединений [5, 10, 11]. a-Чаконин токсичнее a-соланина. Отмечается также выраженный синергизм их действия на эмбрионы Xenopus и влечение улиток к пище. Эти особенности действия объясняются различиями в олигосахаридной части a-соланина и a-чаконина, состоящих из глюкозы-галактозы-рамнозы и рамнозы-глюкозы-рамнозы, соответственно [12, 13]
Тем не менее, вопрос о том, являются ли ГА непосредственной причиной отравлений, вызванных потреблением картофеля и продуктов из него, не имеет окончательного ответа. Согласно данным ряда исследований [1, 5], экстракты из картофеля проявляют большую токсичность, чем находящиеся в нем количества чистых препаратов ГА. Известно, что картофель, помимо ГА, содержит и другие природные токсины, такие, как сапонины, фенолы и глюкозиды, а также ингибиторы протеаз и лектины. Последние вещества существенно инактивируются в процессе варки и термообработки картофеля, но потребление его в сыром или недостаточно обработанном виде также может вызвать интоксикацию. Недавно в глазках и проростках картофеля были обнаружены алкалоиды, калистепины с ингибиторной глюкозидазной активностью [2]. Наличие в картофеле указанных токсинов и других веществ представляет большой риск для здоровья по сравнению с возможными остатками пестицидов. В последнее время интерес исследователей к содержанию природных токсинов в картофеле значительно возрос в связи с увеличивающимися масштабами его производства с использованием биотехнологических подходов (получение трансгенных сортов и микроклубней). Содержание в них природных токсинов может оказаться неожиданно высоким [14].
Целью настоящей работы было изучение токсичности проростков картофеля в субхроническом эксперименте на белых крысах.
Материалы и методы исследования
В эксперименте были использованы крысы линии Wistar. Животным на протяжении 2 мес ежедневно внутрижелудочно вводили суспензию высушенных проростков картофеля в количестве 2,25 г/кг массы животного.
После декапитации под рауш-наркозом (эфир) у животных извлекали органы и определяли их массовый коэффициент (М) по формуле:
Активность ферментов аспартат- и аланинаминотрансфераз (АсТ и АлТ) в сыворотке крови осуществляли методом Райтмана-Френкеля, применяя стандартные наборы (АТ "Реагент", г. Днепропетровск). Определение Кi a-соланина и a-чаконина к БХЭ сыворотки проводили в фосфатном буфере рН 7,7, содержащем 0,25 мМ дитиобиснитробензоат (ДТНБ). Различные концентрации ГА растворяли в 0,05 М соляной кислоте. Активность лактатдегидрогеназы определяли спектрофотометрически по превращению НАД в НАДН [16].
Активность бутирил- и ацетилхолинэстераз в сыворотке крови и тенях эритроцитов определяли с помощью стандартных наборов "RANDOX U.K." Активность 5'-нуклеотидазы определяли в инкубационной смеси, содержащей 4 мМ АМФ, 3 мМ МgSO4, 50 мМ трис-НСl, рН 7,5 и соответствующее начальной скорости реакции количество теней эритроцитов. Реакция протекала при 37°С на протяжении 30 мин; ее прекращали добавлением холодной ТХУ. Денатурированный белок осаждали центрифугированием. В супернатанте количество Рн определяли методом Чена [17]. Интенсивность перекисного окисления липидов (ПОЛ) в ткани печени оценивали по уровню накопления малонового диальдегида (МДА) согласно методу [18].
ЕПР-спектроскопию проводили согласно [19]. Образцы ткани печени и крови, помещенные в специальную капсулу, замораживали в жидком азоте и регистрировали их спектры при помощи радиоспектрометра "Varian E-109" при температуре жидкого азота. Запись спектров ЕПР проводили в таких условиях: мощность СВЧ — 5 мВт (при регистрации СР — 0,2 мВт); магнитное поле 0,25—0,35 Тл (при регистрации Fe(3±) 0,1—0,2 Тл); частота СВЧ 9,5—9,6 ГГц; частота модуляции 100 кГц; амплитуда модуляции 0,8 мТл (при регистрации СР 0,02 мТл). Оценку проводили, измеряя амплитуду ЕПР-сигнала с определением g-составляющей. В качестве внутреннего стандарта использовали рубин, размещенный внутри резонатора и дающий ЕПР-спектр определенной интенсивности в зависимости от условий записи и резонансных свойств исследуемого образца. Результаты выражали в относительных единицах как часть между размахами ЕПР-сигнала образца и стандарта (далее, полученные величины нормировали на среднее значение в контрольной группе). Конечный результат подан в виде выраженных в процентах изменений относительно контрольной группы. В спектре тканей печени определяли следующие сигналы: g=2,25 — цитохром р-450 с гемовым железом в низкоспиновой окисленной форме; g=2,14 — Mn(2±) содержащие белки ендоплазматического ретикулума; g=2,05 — Cu(2±) содержащие белки, такие как супероксиддисмутаза и цитохромоксидаза; gср=2,03 — количество динитрозильных комплексов негемового железа с парными тиоловыми группами белков и низкомолекулярных лигандов; g=2,00 — митохондриальные флавопротеины в свободнорадикальной (СР) семихинонной форме; g=1,97 — ферменты ксантиноксидаза и формиатдегидрогеназа, содержащие атом молибдена в активном центре, а также g=1,94 — железосерные белки митохондриальных дыхательных цепочек с негемовым железом в восстановленном состоянии. В спектре ЕПР крови определяли такие сигналы: g=6,0 — метгемоглобин с гемовым железом в окисленной высокоспиновой форме; g=4,2 — трансферрин; g=2,05 — церулоплазмин; g=2,03 — нитрозильный комплекс гемоглобина (Hb-NO) и g=2,00 — свободные радикалы.
Для получения теней эритроцитов кровь, обработанную гепарином, центрифугировали, плазму и лейкоциты удаляли. Осажденные эритроциты один раз промывали водой и затем 4 раза 0,4% раствором лимонной кислоты.
Осмотическую резистентность эритроцитов определяли по отношению к гипотоническим растворам NaCl [20]. Гемолиз эритроцитов измеряли с помощью спектрофотометра СФ-16 при длине волны 540 нм.
Результаты и их обсуждение
У крыс (табл. 1), получавших проростки картофеля, отсутствуют сколько-нибудь существенные изменения массы тела и весовых коэффициентов органов животных, аланин- и аспартатаминотрансферазной активности сыворотки крови (табл. 2).
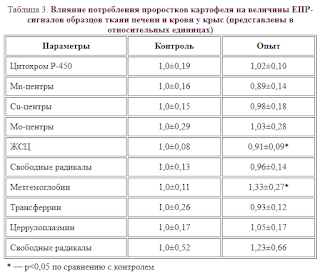
Отсутствовали изменения величины ЭПР-сигналов гемового железа в низкоспиновой окисленной форме Mn, Cu, Mo, а также свободных радикалов в печени, в определенной мере отражающих функцию таких ферментов, как супероксиддисмутаза, цитохромоксидаза, АТФ-аза, протеинкиназа, ксантиноксидаза, формиатдегидрогеназа и цитохромы Р-450. В крови животных, получавших ГА, отсутствовали изменения в величине сигналов ЭПР, характерных для церуллоплазмина, трансферина и свободных радикалов крови. В печени контрольных и опытных животных не было обнаружено динитрозильных комплексов железа с парными тиоловыми групами белков, а в крови отсутствовали нитрозильные комплексы с гемовым железом (табл. 3).
Крысам вводилось максимально возможное количество проростков картофеля с высоким содержанием a-соланина и a-чаконина: 1000 мг на 100 г проростков. Но и при этих агравированных условиях эксперимента ежедневно вводимая доза указанных токсинов (22,5 мг /кг массы тела крысы) была значительно меньше LD50, которая для крыс при однократном интраперитонеальном введении составляет 84 мг/кг и 67 мг/кг соответственно для a-чаконина и a-соланина [21]. Оральные дозы для этих соединений на порядок выше в силу их плохой всасываемости из желудочно-кишечного тракта. Например, у крыс для a-соланина LD50 составляет 590 мг/кг [2]. Отсюда следует, что нами ежедневно вводилась доза ГА менее 1/20 LD50. Этим, возможно, объясняется отсутствие у крыс, получавших проростки картофеля, изменений интегральных показателей (масса тела и массовые коэффициенты, активность АсТ и АлТ) и ЭПР показателей, отражающих состояние мембранно-транспортных и детоксикационных процессов, а также обмена железа и оксида азота в организме.
Вместе с тем, у опытных крыс отмечались некоторые проявления интоксикации в виде диареи и вялости поведения. Выявлено снижение резистентности эритроцитов (рис. 1), что свидетельствует об изменениях со стороны их мембран. О модификации мембран свидетельствует также возрастание в 1,55 раза в тенях эритроцитов активности 5'-нуклеотидазы, являющейся интегральным мембранным белком (табл. 4).
Методом ЭПР-спектроскопии выявлено уменьшение количества восстановленных железосерных комплексов в митохондриях, обеспечивающих функцию электронно-транспортной цепи внутренней мембраны митохондрий (табл. 3).
Тимус является органом наиболее чувствительным к воздействию химических и физических факторов [22]. На величине весового коэффициента тимуса это не отразится лишь в том случае, если гибель клеток в нем выражена слабо. К тому же следует учесть, что необходимо время для утилизации погибших тимоцитов, и что тимус постоянно восполняется новыми клетками, мигрирующими из костного мозга. Поэтому нами для оценки тимотропного действия ГА, помимо весового коэфициента, использованы такие показатели, как количество белка в бесклеточной фракции, полученной из тимуса, и выживаемость выделенных из него тимоцитов в культуральной среде. В результате скармливания крысам проростков картофеля существенно возрастает количество белка в бесклеточной фракции тимуса. Так, у контрольных животных оно составляло 84,9±6,6 мг/г сырого веса тимуса, а у опытных крыс — 112,7±10,7 мг/г. Гибель тимоцитов, выделенных из тимусов контрольных и опытных крыс, при их инкубации в среде Хенкса в течение 7 ч составляла 8,39±0,79% и 18,23±1,84% соответственно, что указывает на цитотоксическое действие проростков картофеля на тимоциты.
В печени опытных животных отмечается возрастание интенсивности перекисного окисления липидов: спонтанного — на 29%, а аскорбат-зависимого — на 33% (табл. 5). Вместе с тем снижалась активность каталазы сыворотки крови (табл. 2). Эти данные свидетельствует об усилении свободнорадикальных процессов в организме опытных животных. Возможно, что с состоянием оксидативного стресса связано увеличение на 33% количества высокоспинового met-hb, наблюдаемое в крови крыс, потреблявших ГА (табл. 3).
Мембраннотропная и прооксидативная направленность изменений исследуемых показателей у крыс, получавших проростки картофеля, очевидно, связана с влиянием на организм находящихся в них a-соланина и a-чаконина. На это указывает снижение у опытных крыс активности бутирилхолинэстеразы в сыворотке крови почти в 2 раза (табл. 2) и активности ацетилхолинэстеразы в "тенях" эритроцитов на 45% (табл. 4) по сравнению с контрольной группой животных.
Отношение a-соланина к a-чаконину в проростках картофеля составляло 1:1,36. В опытах in vitro определены также константы ингибирования (Кi) для a-соланина и a-чаконина в отношении БХЭ сыворотки крови крыс, которые составляют соответственно 22 и 12 mМ. Учитывая эти данные, а также величины снижения активностей БХЭ сыворотки крови крыс и АХЭ эритроцитов можно рассчитать эффективную концентрацию ГА в сыворотке крови. Активность фермента in vivo при действии ингибитора аппроксимируется формулой:
Учитывая, что a-соланин и a-чаконин оказывает независимое действие на БХЭ крови, получили следующую формулу для расчета:
где ach и asol — долевые коэффициенты содержания a-соланина и a-чаконина в проростках картошки (0,58 и 0,42 соответственно), А/Аi =188/90; Ki_sol=22 mМ; Ki_chac=12 mМ. В результате расчета получено общее содержание a-соланина и a-чаконина в сыворотке крови крыс — 16,2 mМ (9,4 mМ a-соланина и 6,8 mМ a-чаконина).
Как видно из рис. 2, цитотоксичность a-соланина и a-чаконина для тимоцитов с учетом синергизма их действия проявляется при более низких концентрациях. Возможно, еще более низкие концентрации ГА явились причиной изменений, выявленных в тимусе опытных крыс. Известно [23], что экстракт проростков картофеля вызывает гемолиз эритроцитов, зависящий как от количества содержащихся в нем ГА, так и от концентрации клеток в суспензии. Экстраполяция полученных в работе результатов показывает, что при нормальном для крови крыс количестве эритроцитов (около 7•109 кл/мл) для гемолиза около 20% эритроцитов потребуется 500 mМ концентрация ГА.
Различные ткани, включая печень и тимус, способны накапливать a-соланин и a-чаконин [2]. Так как повреждающее воздействие проростков картофеля, содержащих значительные дозы a-соланина и a-чаконина, при скармливании крысам в течение 2 мес не привело к существенным изменениям биомаркеров целостности гепатоцитов (активность АсТ и АлТ сыворотки крови) и гибель тимоцитов как наиболее чувствительных к повреждающим воздействиям клеток не носила выраженного характера, можно прийти к выводу, что в желудочно-кишечном тракте всасывалась лишь небольшая часть этих соединений и их кумулятивные свойства выражены слабо. Согласно данным других исследователей [24], чувствительность к ГА крыс значительно слабее, чем у других видов животных и человека. В частности, у последних величины Кi для БХЭ сыворотки крови для a-соланина и a-чаконина оказались значительно ниже, чем определенные нами у крыс.
ГА интересуют исследователей не только как природные токсины, но и как компоненты с возможными фармакологическими свойствами. Цитотоксическое действие ГА давно и успешно используется при лечении некоторых форм рака кожи [25]. В последние годы интенсивно изучается их воздействие на другие злокачественные образования [26]. Антихолинэстеразное действие ГА может найти свое применение для пролонгирования действия аспирина, кокаина и других сложных эфиров, миорелаксантов и других препаратов, в расщеплении которых участвуют АХЭ и БХЭ [27]. Соланин использовался как средство против глистов, а также для лечения бронхитов, эпилепсии, астмы и сальмонелезной инфекции [2, 29, 30].
Статистическая обработка данных проводилась с использованием компьютерной программы Statistica и Excel.
Литература
1. Smith D.B., Roddick J.G., Jones J.L. Potato glycoalkaloids: Someunswered questions // Food Science & Technology. —1996. —V. 7. —P. 126—131.
2. Consensus document on compositional considerations for new varieties of potatoes: key food and feed nutrients, anti-nutrients and toxicants // OECD Environmental Health and Safety Publications. Series on the safety of novel foods and feeds. —2002. —N4. —26 p.
3. Morgan M.R.A., Coxon D.T. Tolerances: glycoalkaloids in potatoes // Natural Toxicants in Food. Progress and Prospects. Ed. Watson D.H., VCH, Weinheim, 1987. —P. 221—230.
4. Phillips B.J., Hughes J.A., Phillips J.C., Walters D.G., Anderson D., Tahourdin C.S. A study of the hazard that might be associated with the consumption of green potato tops // Food Chem. Toxicol. —1996. —34, N5. —P. 439—448.
5. Tice R. a-Chaconine [20562—03—2] and a-Solanine [20562—02—1] // The National Toxicology Program (NTP), within the U.S. Department of Health and Human Services. —Contract No. N01—ES—65402, 1998. —P. 1—54.
6. Keukens E.A.J., Vrije T., Boom C., Waard P., Plasman H.H., Thiel F., Chupin V., Jongen W.M.F., Kruijff B. Molecular basis of glycoalkaloid induced membrane distruption // Biochim. Biophys. Acta. —1995. —1240, N1. —P. 216—228.
7. Keukens E.A.J., Vrije T., Jansen L.A.M., Boer H., Janssen M., Kroon A.I.P.M., Jongen W.M.F., Kruijff B. Glycoalkaloids selectively permeabilize cholesterol containing biomembranes // Biochim. Biophys. Acta. —1996. —1279, N2. —P. 243—250.
8. Wierenga J.M., Hollingworth R.M. Inhibition of insect acetylcholinesterase by the potato glycoalkaloids alpha-chaconine // Nat. Toxins. —1992. —1, N2. —P. 96—99.
9. Nigg H.N., Ramos L.E., Graham E.M., Sterling J., Brown S., Cornell J.A. Inhibition of human plasma and butyrylcholinesterase 9EC (3.1.1.8) by a-chaconine and a-solanine // Fundamental and applied toxicology. —1996. —33. —P. 272—281.
10. Chaube S., Swinyard C.A. Teratological and toxicological studies of alkaloidal and phenolic compounds from Solanum Tuberosum L. // Toxicol. and Appl. Pharmacol. —1976. —36. —P. 227—237.
11. Crawford L., Myhr B. A preliminary assessment of the toxic and mutagenic potential of steroidal alkaloids in transgenic mice // Fd. Chem. Toxic. —1995. —33, N3. —P. 191—194.
12. Rayburn J.R., Friedman N., Bantle J.A. Synergistic interaction of glycoalkaloids a-chaconine and a-solanine on developmental toxicity in Xenopus Embryos // Fd. Chem. Toxic. —1995. —33, N12. —P. 1013—1019.
13. Smith D.B., Roddick J.G., Jones J.L. Synergism between the potato glycoalkaloids a-chaconine and a-solanine in inhibition of snail feeding // Phytochemistry. —2001. —57. —P. 229—234.
14. Kuiper H.A. , Kleter G. A., Noteborn H. P. J. M., Kok E. J. Assessment of the food safety issues related to genetically modified foods // The Plant Journal. —2001. —27, N6. —P. 503—528.
15. Lowry O.H., Rosenbrough H.F., Farr A.L., Randall R.J. Protein measurement with the pholin phenol reagent // J. Biol. Chem. —1951. —143. —P. 265—275.
16. Колб В.Г., Камышников В.С. Справочник по клинической химии —Минск: "Беларусь", 1982. —336 с.
17. Chen P.S., Toribara J.T.Y., Warner H. Microdetermination of phosphorus // Anal. Chem. —1956. —28. —P. 1756—1758.
18. Кузьминская У.А., Кокаровцева М.Г., Овсянникова Л.М. Биохимические, иммунологические и биофизические методы в токсикологическом эксперименте // Метод. рук-во. —Киев, 1989. —184 с.
19. Ажипа Я.И. Медико-биологические аспекты применения метода ЭПР. —М: Наука,1983. —528 с.
20. Тодоров Й. Клинические лабораторные исследования в педиатрии // София: Госиздат "Медицина и физкультура", 1963. —874 с.
21. Chaube S., Swinyard C.A. Teratological and toxicological studies of alkaloidal and phenolic compounds from Solanum tuberosum // Toxicol. Appl. Pharmacol. —1976. —36. —P. 227—237.
22. Брондз Б.Д., Рохлин О.В. Молекулярные и клеточные основы иммунологического распознавания // Москва: "Наука", 1978. —333 с.
23. Phillips B.J., Hughes J.C., Phillips J.C., Walters D.G., Anderson D., Tahourdin C.S.M. A study of the toxic hazard that might be associated with the consumption of green potato tops // Food and Chem. Toxicol. —1996. —34. —P. 439—448.
24. Nigg H.N., Ramos L.E., Graham E.M., Sterling J., Brown S., Cornell J.A. Inhibition of human plasma and serum butyrylcholinesterase (EC 3.1.1.8) by a-Chaconine and a-solanine// Fundamental and applied toxicology. —1996. —33. —P. 272—281.
25. Cham B.E., Meares H.M. Glycoalkaloids from Solanum sodomaeum are effective in the treatment of skin cancers in man// Cancer Lett. —1987. —36, №2. —Р. 111—118.
26. Kuo KW, Hsu SH, Li YP, Lin WL, Liu LF, Chang LC, Lin CC, Lin CN, Sheu HM. Anticancer activity evaluation of the solanum glycoalkaloid solamargine. Triggering apoptosis in human hepatoma cells // Biochem Pharmacol. —2000. —60, №12. —Р. 1865—1873.
27. Schwarz M., Glik D., Loewenstein Y., Soreq H. E. Engineering of human cholinesterases explains and predicts diverse consequences of administration of various drugs and poisons // Pharmac.Ther. —1995. —67, N2. —P. 283—322.
28. Krasowski M.D., McGeehee D.S., Moss J. Natural inhibitors of cholinesterases: implications for adverse drug reactions // Canadian J. Anesthesia. —1997. —44. —P. 525—534.
29. McGeehee D.S., Krasowski M.D., Fung D.L., Wilson B., Gronert G.A., Moss J. Cholinesterase inhibition by potato glycoalkaloids slows mivacuriu // Anesthesiology. —2000. —93. —P. 510—519.
30. W.B. Saunders Co. Dorland's Illustrated Medical Dictionary. 28th ed., Philadelphia, 1994.